A Anvisa (Agência Nacional de Vigilância Sanitária) aprovou a entrada no País de medicamentos com até 30 mg/ml de CBD (canabidiol) e THC (tetrahidrocannabinol), dois importantes derivados da maconha. Decisão foi proferida pela reunião de diretores da agência na terça-feira (22) e deve ser publicada no Diário Oficial nos próximos dias.
Essa resolução difere de mecanismos de importação vigentes desde 2014 para o uso canabidiol de modo excepcional. Nessa importação, portadores de doenças graves para as quais não há equivalente terapêutico, podem importar a substância e usá-la por conta, assinando um termo de responsabilidade. O canabidiol não é um medicamento: pacientes usam o composto na tentativa de obter efeitos positivos (clique aqui para mais informações).
Agora, o que a portaria da Anvisa faz é permitir que medicamentos com substâncias da maconha sejam aprovados, desde que respeitados os limites de concentração (30 mg/ml). A medida abre espaço no mercado para novos produtos, mas isso não significa que eles já estão disponíveis nas gôndolas das farmácias ou que podem ser usados imediatamente.
As empresas ainda precisarão realizar todos os testes clínicos e submetê-los à aprovação da agência. A diferença é que agora elas podem fazer isso com derivados da maconha, que antes não eram permitidos em nenhuma concentração.
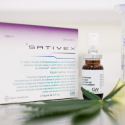
A liberação foi motivada pelo processo de registro do medicamento Mevatyl, que está em fase final. O produto é usado para sintomas da esclerose múltipla (EM) e é mais conhecido com o nome de Sativex. A EM é uma doença sem cura em que o sistema imunológico corroi membranas que ataca os nervos. Provoca uma série de sintomas: fadiga, dificuldades de fala e movimento, disfunções da bexiga e do intestino. A Associação Brasileira de Esclerose Múltipla (ABEM) estima que 35 mil brasileiros vivam com a doença. O sativex atua em um sintoma específico: a espasticidade, rigidez muscular que está associada a disfunções de movimento.

A abertura da agência para derivados da maconha começou em 2014, quando pacientes passaram a pleitear na Justiça o direito à importação do canabidiol, substância que apresenta resultados satisfatórios principalmente para o tratamento de epilepsias graves. Motivada por essa luta, a agência retirou a substância da lista de substâncias proscritas e pacientes puderam, em regime especial, importar o CBD.
A importação, no entanto, é permeada de burocracias e atrasos: pacientes devem apresentar receita e laudo médico, termo de responsabilidade e preencher um formulário especial. As doenças também devem ser graves e não terem equivalente terapêutico no País.
Uso de outros derivados e importação agilizada
Uma outra novidade em relação à importação do CBD é que a agência adicionou novas empresas para a lista de importação. Esse processo foi adotado após a retirada do CBD da lista de substâncias proscritas e permite que a agência tenha um controle dos produtos que entram no País e sua confiabilidade. Segue a lista de empresas permitidas:
|
Nome do Produto |
Nome da Empresa |
|
Cibdex Hemp CBD Complex |
Hemp Meds Px |
|
Hemp Blend |
Bluebird Botanicals |
|
Real Scientific Hemp Oil (RSHO) CBD |
Hemp Meds Px |
|
Revivid LLC Hemp Tincture |
Revivid |
|
CBDRX CBD Oil |
CBDRX |
|
Charlotte Web Hemp Extract |
CW Botanicals |
|
Endoca Hemp Oil |
Endoca |
|
Elixinol Hemp Oil CBD |
Elixinol |
|
EVR Hemp Oil CBD |
EVR |
|
Mary’s Elite CBD Remedy Oil |
Mary’s Nutritionals |
|
Purodiol CBD |
Purodiol Limited UK |
Deixe um comentário